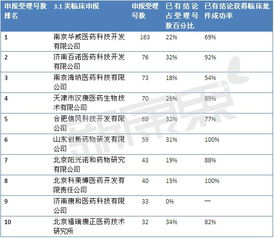
2015年《國務(wù)院關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》(即業(yè)內(nèi)常稱的117號文)實施后,藥品審評審批制度迎來深刻變革,對臨床批件技術(shù)轉(zhuǎn)讓市場產(chǎn)生了顯著影響。其中,部分轉(zhuǎn)讓項目因政策調(diào)整而價值被低估,為具備戰(zhàn)略眼光的企業(yè)提供了“抄底”機遇。
在117號文強調(diào)的“優(yōu)化審評審批、鼓勵創(chuàng)新”背景下,以下三類臨床批件技術(shù)轉(zhuǎn)讓項目值得重點關(guān)注:
1. 已通過臨床自查核查的優(yōu)質(zhì)項目
117號文后,國家加強臨床數(shù)據(jù)核查,大量存疑項目被清理。那些已通過嚴格自查、數(shù)據(jù)真實完整的臨床批件,其技術(shù)成熟度和審評風(fēng)險顯著降低。這類項目轉(zhuǎn)讓方可能因資金壓力或戰(zhàn)略調(diào)整低價出手,接手企業(yè)可規(guī)避前期研發(fā)風(fēng)險,直接推進后續(xù)臨床。
2. 符合“罕見病、兒童用藥”政策導(dǎo)向的項目
117號文明確鼓勵罕見病用藥和兒童用藥研發(fā),并給予優(yōu)先審評等支持。若轉(zhuǎn)讓項目涉及這些領(lǐng)域,且已完成早期臨床研究,其市場潛力和政策紅利尚未被充分定價。企業(yè)可借轉(zhuǎn)讓獲取技術(shù),快速布局政策藍海。
3. 原研藥企戰(zhàn)略剝離的非核心項目
部分跨國藥企或大型本土企業(yè)為聚焦核心管線,可能剝離與主業(yè)關(guān)聯(lián)度低的臨床批件。這些項目往往技術(shù)基礎(chǔ)扎實,但因戰(zhàn)略調(diào)整被低價轉(zhuǎn)讓。接手企業(yè)可通過二次開發(fā)或差異化定位,挖掘其潛在價值。
值得注意的是,“抄底”需綜合評估技術(shù)成熟度、市場容量及企業(yè)自身承接能力。117號文推動行業(yè)洗牌的也要求投資者更注重項目的臨床價值與合規(guī)性,避免因盲目追逐低價而陷入后續(xù)研發(fā)困境。